当研究室で微量注入(マイクロインジェクション)に用いる物質は、主に組織から抽出した mRNA (poly-A RNA) 、あるいはクローン化された cRNA である。これらの調整法については他の章を参考にしてほしい。本章では、1. マイクロピペットの作製、2. アフリカツメガエル卵母細胞の調製、3. マイクロインジェクションについて説明する。
( cRNA の合成には Ambion MEGAscriptを使用する。テンプレートにするプラスミドにより SP6 ( Catalog # 1330), T7 (1334), T3 (1338) の各キットを使い分ける。詳細なマニュアルがキットに添付されている)
マイクロピペットは Drummond 社の glass tubing (フナコシ取扱い, コード: 3-00-210-G8 )から作製する。これは、いつも電気生理で用いる電極用キャピラリー(ハイレックスキャピラリー外径 1.4 mm 中芯入)と共にサミットメデイカルに注文している。
1-1. ガラス管の引き伸ばし方
RNA インジェクション用マイクロピペットおよび記録用電極の作製は、微小電極作製器(PN-3, 成茂科学)を用いて行う。これはガラス管の中央を電気白熱ヒーターで過熱し、マグネットを制御してガラス管を引き伸ばす装置であり、左右一対のマイクロピペットを作成できる。装置の調節により、先端が 1 万分の 1 mm まで細い針先を作ることができる。
最終的に針の太さを決定するのは、針を折り、研磨する時点である。このガラス管引き伸ばしの時点で重要なのは、テーパーおよび二段引きの部分に弾性があり、長く、均一な太さの先端部を作ることである。また、この機械(横引き)の癖から、たいてい左右の針は不均等な仕上がりとなる。しかし、針を折り、研磨する時点で、調整されるので実用上問題はない。
(記録用電極は先端が細く、閉じたものを使用する)
実験操作:
1) ガラス管の中央部にあらかじめ印をつけておき、ここを白熱ヒーターの部分に合わせ、その両端をそれぞれチャックとガラス管固定器具に装着する。
2) 作成するマイクロピペットの形状を装置のダイヤルによって調節する。ダイヤルは、左からヒーター調節ダイヤル(ヒーターの熱量を調節)、サブマグネット調節ダイヤル(一段引きの牽引力を調節)、メインマグネット調節ダイヤル(二段引きの牽引力を調節)がある。全く初めての場合は、ヒーター (21-0) , サブマグネット (8-0) , メインマグネット (9-0) あたりから始めると良い。基本的には、ヒーターが強いほど、針は長くなり、牽引力が強いほど短くなる。一段引きは、針の根元の部分の形成に関わり、二段引きは先端部の形成に関わる。
3) スタートボタンを押す。引き伸ばされたガラス管を、針先に注意して装置より外す。
1-2. 針の折りかた
RNA インジェクション用マイクロピペットは、電極作製器で引き伸ばしただけでは、先端部が細すぎて使用できないため、適当な太さのところで折る必要がある。引き伸ばしたガラス管を 18 ゲージ注射針で macroscopic に折り、顕微鏡下で直径を確認する。同じ RNA インジェクション用マイクロピペットであっても、poly-A RNA の時と cRNA の時では溶液の粘度や精製度が異なるため、用いる針先の太さを、直径 15-25 micro m の範囲で使い分ける必要がある(cRNA のマイクロインジェクション用には 18 micro m 程度が最適である)。一般に 15 micro m より細いと詰まりやすく、20 micro m より太いと卵母細胞へのインジェクション孔が塞がりにくくなる。その後の実験結果に影響するため、良い針を作ることは非常に重要である。
1-3. 研磨の仕方
回転砥石 ("Kapillar-Schleifgeraet mit Aufnahme fuer Olympos Stereomikroskop" Klaus Effenberger Med.-Techn. Geraetebau Hochgernstrasse 16, 83539 Pfaffing/Attel, Germany) で針先を研磨する。
実験操作:
1) 用意したガラス管を固定台に挟み、砥石との角度を 40-45 °程度とする。点滴ライン、あるいは洗浄瓶を用いて蒸留水を滴下する。
乾いたままの使用はうまく研げず、砥石を痛めてしまうため行ってはならない。先端が細いほど、点滴のように一定のスピードで滴下し、砥石がわずかに湿った状態を保つ。
2) ハンドルをゆっくり回して静かにガラス管の先を砥石に触れさせる。針先のしなり方とこの時生じる高周波の音を頼りに、数秒ほど研磨する。研ぎ終わったら顕微鏡で針先の仕上がりと太さを確認する。
うまく研げると、注射針状にきれいにとがる。実際には、ある程度鋭利になっていれば、実用上問題はない。うまく研げない場合は、納得いくまで操作を繰り返す。いいかげんな針を作って、インジェクションの時に苦労するより、ここで時間をかける方が、実験全体の時間を節約することになる。
毛細管現象により、ガラス管が研磨に用いた水とともに研ぎかすを吸い上げることがあるので、時々砥石表面をキムワイプで拭うと良い。
3) 出来上がった針は、一本ずつ試験管に入れ、乾熱滅菌を行う。

アフリカツメガエルの卵巣は左右の下腹部に数房ずつ分葉しており、一房から約 100 個程度の実験に使用可能な卵母細胞が得られる。卵母細胞は成長段階に従って 6 つのステージに分けられる。その中で発現実験に用いられるのは、成長の進んだステージ 5 および 6 である。とくに動物極の色が濃く、動物極と植物極の境界がはっきりしたものを使用する。重要な実験の場合は 2-3 匹から摘出し、状態の良いものを選ぶ。
卵母細胞は高温( 25 ℃以上)にはきわめて弱い。とくに夏期はすべての操作にわたって温度管理を十分に行う必要がある(操作途中はなるべく卵母細胞を氷上に置き、温度の上昇を防ぐ)。当研究室では、アフリカツメガエルを 18 ℃で一定条件下に飼育しているが、卵母細胞での発現実験は冬季に安定した実験結果が得られるようである。
卵母細胞の移動などには、卵母細胞吸い取り用のパスツールピペットを用いる。パスツールピペットを、切り口が 1.5-2.0 mm になるように先端を切り、卵母細胞が傷つかないように先端を焼きなまし、滅菌して使用する。
試薬:
Modified Barth's Saline (MBS)
88.0 mM NaCl
1.0 mM KCl
2.4 mM NaHCO3
0.3 mM Ca (NO3) 2
0.41 mM CaCl2
0.82 mM MgSO4
1000 IU/mL penicillin
100 micro g/mL streptomycin
ストック溶液
A 液(/500 mL pH 7.4 ) : NaCl 64 g, KCl 1 g, NaHCO3 2.5 g, Tris-base 22.5 g
B (Ca) 液 (/100 mL) : Ca (NO3)2・4H2O 0.95 g, CaCl2・2H2O 0.755 g
B (Mg) 液 (/400 mL) : MgSO4・7H2O 2.5 g
MBS の調製
A 液および B 液を以下の量加え、水で 1 L に fill up する。(抗生物質を加える)
| MBS (+Ca2+) | MBS (-Ca2+) | |
|---|---|---|
| A 液 | 40 mL | 40 mL |
| B (Ca) 液 | 8 mL | - |
| B (Mg) 液 | 32 mL | 32 mL |
実験操作:
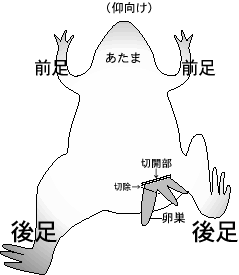
1) アフリカツメガエルを 30 分以上氷中に置いて冬眠状態にした後、アイスボックスの氷上に仰向けにねかせる。下腹部以外は氷で覆っておく。切開する側の後足を曲げておくと、皮膚に弛みが出来て作業しやすい。
2) 左右どちらかの下腹部の皮膚および筋層を 7-10 mm 程度ハサミで切り、ピンセットで卵巣(房状)を引き出し、房の区切りの良いところで切り取る。摘出した卵塊を MBS (-Ca2+) を入れたシャーレ内に入れる。
3) 卵塊を取り出したカエルの下腹部を、水分を拭った後に瞬間接着剤でふさぐ。
4) 眼科用精密ピンセット (FONTAX, INOX 5) を使ってシャーレ内の卵塊の房を裂く。細胞が 10 個程度つながっている状態にしておくと、あとでろ胞細胞( follicular cells )を除きやすい。
5) シャーレ内の MBS (-Ca2+) を一度交換した後、0.2 % コラゲナーゼ溶液 [MBS (-Ca2+)] に交換し、18 ℃で 30 分間ゆっくり振とうする。
6) コラゲナーゼ溶液を除き、MBS (-Ca2+) で 2-3 回卵母細胞を洗浄した後、MBS (+Ca2+) を入れた別のシャーレに移す。この時点で 18 ℃のインキュベーター内へ置き、操作を一時止めることができる。
7) 実体顕微鏡下で精密ピンセットを用いてろ胞細胞を除く。ろ胞細胞を除いた卵母細胞は MBS (+Ca2+) を入れた別のシャーレへ移す。
ろ胞細胞は透明な膜であるが、毛細血管が通っているので、これをたよりにピンセットで剥がす(ろ胞細胞を除いた卵母細胞は弾力が若干失われる)。ろ胞細胞を除いた卵母細胞はなおビリテン膜( vitelline envelope )で覆われているが、マイクロインジェクションおよび通常の膜電位固定法の実験はこの状態で行う。
ろ胞細胞 除去の際に卵母細胞を傷つけてしまうことが多い。このような傷ついた細胞は一晩で死んでしまう。操作に慣れないうちは、一晩インキュベーションし、生きの良い細胞だけを選んでインジェクションを行うようにすると良い。
3-1. マイクロディスペンサーへのマイクロピペットの装着
実験操作:
1) マイクロピペットの根元から、止め具(ネジ)とパッキングのゴムをあらかじめはめておく。
2) 10 micro L 用 マイクロディスペンサー( Drummond, フナコシ扱い)の目盛りを 5 micro L 前後 に合わせる。(吸い上げる RNA の量。一回に 5 micro L 以上 load することはない)
3) マイクロピペットと マイクロディスペンサー を並べて置き、マイクロピペットに入れるパラフィンの量の見当をつける。マジックで印をつけておくと良い。
4) 5mL のシリンジに流動パラフィンを入れ、カテラン針を取り付ける。
5) カテラン針をマイクロピペットにさし込み(マジックで印を付けた所まで)、見当をつけた量の流動パラフィンを注入する。この時、空気が入らないように注意する。あらかじめ空打ちをして空気を抜いておくことと、パラフィンを注入する際に、針そのものはゆっくりと引いていくのがコツ。
6) マイクロピペットをマイクロディスペンサーに装着する。この時、流動パラフィンが先端からわずかに流出するところを確認しておく(先端まで十分に充填されていること)。マイクロディスペンサーのダイヤルは、時計回りが押出す方向、反時計回りが吸い上げる方向である。
7) マニピュレーター(成茂科学)を実体顕微鏡の右脇に設置し(実験机に鉄板を置いておきマグネットで固定する)、マイクロディスペンサーをこれに装着する。
3-2. インジェクション溶液の loading
実験操作:
1) パラフィルム( RNase freeとする)を実体顕微鏡に置き、パラフィルム上にインジェクションする RNA 溶液の水球( 5 micro L 程度の水滴)をつくる。
2) マニピュレーターを使ってマイクロピペットの先端を水滴の中まで押し進める。
3) マイクロディスペンサーのダイヤル を少し時計回りに回転させ流動パラフィンが水滴中に出てくることを確認する。次にダイヤルを反時計回りにゆっくりと回転させ、マイクロピペット内に溶液を吸い上げる。
マイクロピペットの先が細すぎたり、詰まっていると溶液が上がってこない。またこの時、針の中に空気がたまってくるようだと吸えていないとわかる。
3-3. インジェクション
実験操作:
1) コラゲナーゼ処理後、ろ胞細胞を除いた卵母細胞をテラサキプレートにのせる。
(1 well に 3 個くらいのせると卵が動きにくくやりやすい。medium は wellの縁から少し盛り上がるくらい入れ、卵母細胞を乾かさないように注意する。)
2) マニュピュレーターを使って顕微鏡下マイクロピペットの先端を卵母細胞中に入れる。
(植物極側(白い方)にインジェクションするのが望ましい。動物極直下には核があり、深く刺し過ぎると卵が死ぬ。しかし、テラサキプレートにのせると、たいてい動物極が上にくるため、針の先で少し卵を回転させるなどして、動物極と植物極の境界あたりにインジェクションすることが多い。また、針を突き刺すと、当然卵がへっこみ内圧が上がるので、この状態ですぐインジェクションすると内容物とともに、RNAの多くを loss してしまう。そこで、刺したら気持ち分、針を引き抜いてからインジェクションするとうまくいく。ただし、引き抜きすぎると膜直下の部分にRNAが入ってしまい失敗する。)
3) マイクロディスペンサーのダイヤルをゆっくりと回し、RNA をインジェクションする。一個の卵母細胞(約1 micro L )に対し、50 nL 以下のインジェクション量が好ましい。インジェクション後、数秒待ってから針を引き抜く。
( 50 nL もインジェクションすると、卵が膨らんでいくようすがよくわかるはずである。うまくわからない時は、時々空打ちをして針がつまっていないことを確認しながら進めていく必要がある。マイクロピペットは、詰まったり、ぶつけて折ったりしなければ、1 本で 100 個程度の卵母細胞へのインジェクションが可能である。)
4) インジェクションした卵母細胞は、MBS (+Ca2+) をいれた別のシャーレに移し、18 ℃のインキュベーターに置く。その後、1 日に 1-2 回程度 MBS (+Ca2+) を交換し、いきの良い卵母細胞を測定に用いる。